近日,基础医学院/高等医学研究院刘招舰教授团队在Cell Death & Differentiation(中科院一区TOP/JCR Q1,5年IF=12.895)在线发表题为“Bud31-mediated alternative splicing is required for spermatogonial stem cell self-renewal and differentiation”的研究成果。基础医学院博士研究生秦君超、山东大学齐鲁医院/基础医学院博士后王子翔、山东大学生殖医学研究中心黄涛副研究员为该论文的共同第一作者,基础医学院/高等医学研究院刘招舰教授和山东大学生殖医学研究中心刘洪彬教授为该论文共同通讯作者,山东大学为该论文的第一作者单位和通讯作者单位。
RNA剪接是真核生物基因表达调控的重要环节,是产生基因产物多样性的重要机制。该过程由剪接体(spliceosome)对前体RNA(pre-mRNA)进行加工,去除内含子并连接外显子的过程。人类基因平均有6-8个外显子,约95%的基因发生选择性剪接。选择性剪接与疾病发生密切相关,大约三分之一的遗传病与异常剪接直接或间接相关。选择性剪接在细胞分化及个体发育过程中发挥重要作用并被精准调控。在各种组织器官中,睾丸和脑中选择性剪接最为复杂,精子发生过程中的选择性剪接的调控机制仍未完全阐明。
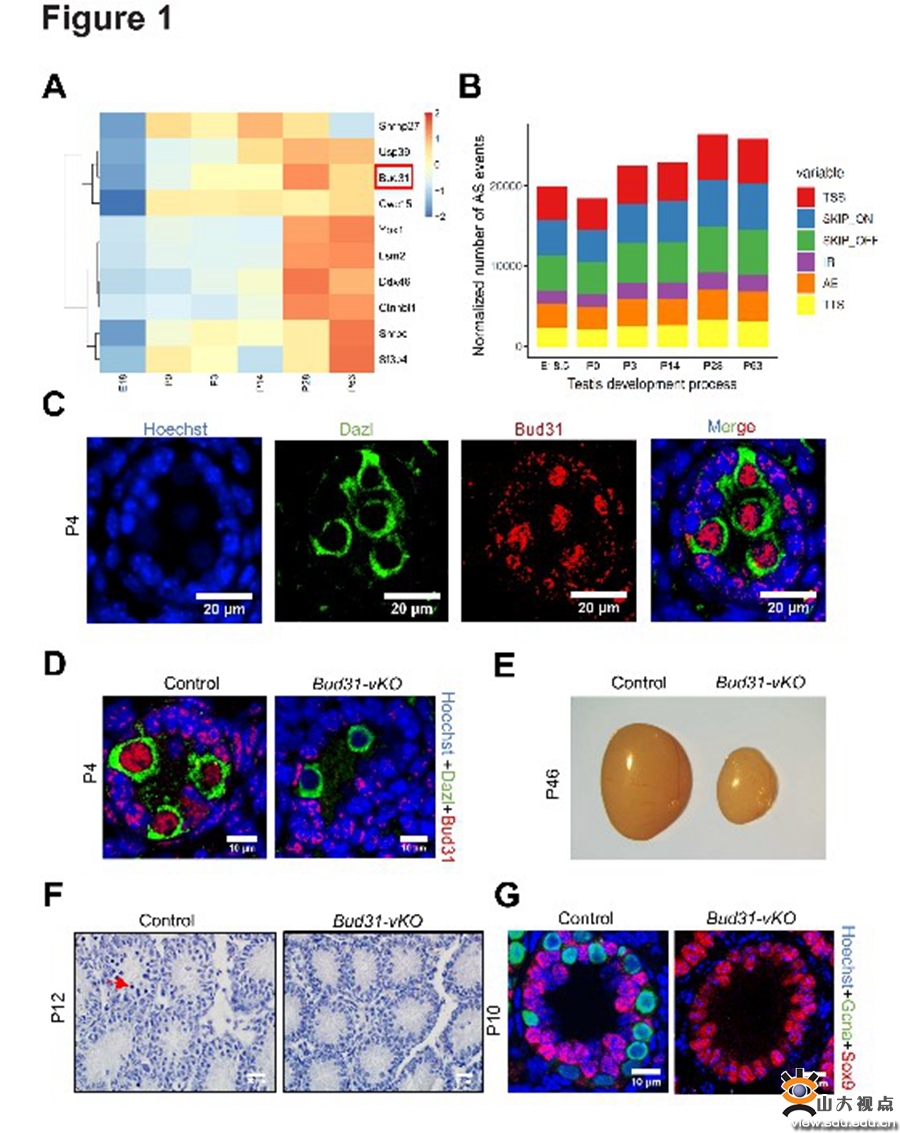
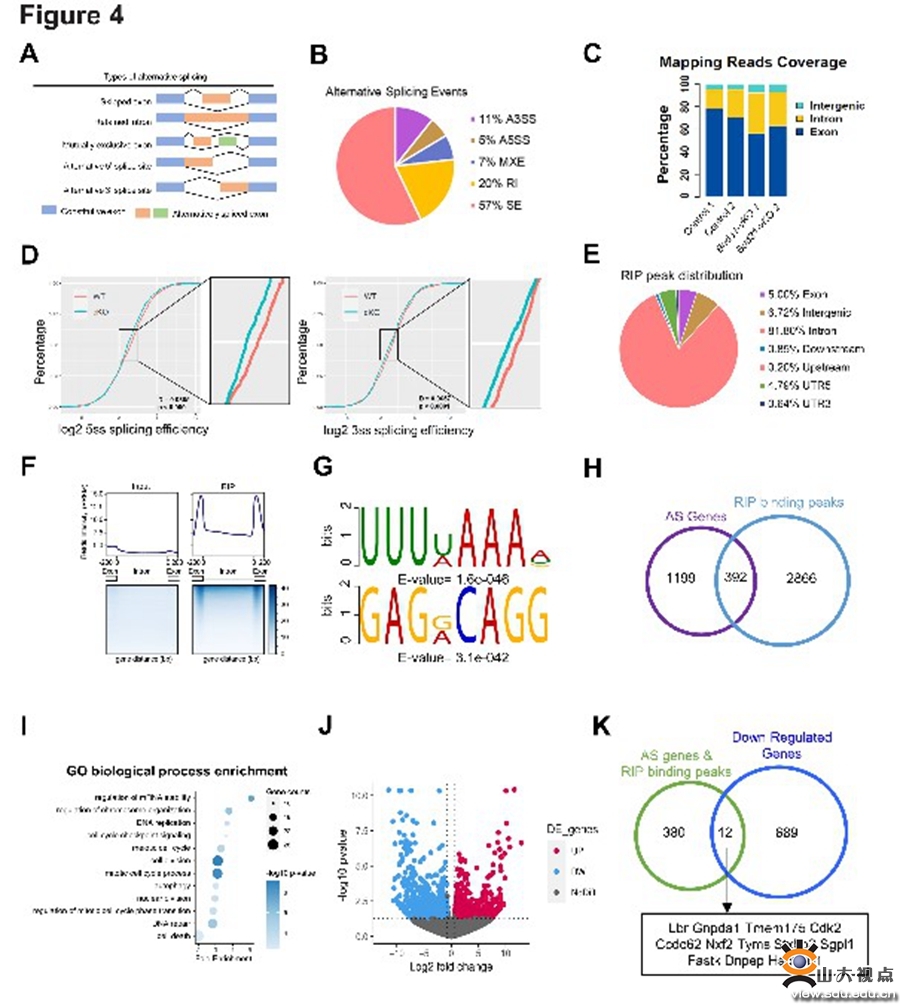
在本研究中,团队通过分析不同发育阶段核心剪接因子的表达,发现剪接因子Bud31在小鼠出生后第3天表达水平显著升高,并与剪接事件数量增加的时间一致;提示Bud31及其调控的选择性剪接参与精子发生的过程。在生殖细胞特异性敲除Bud31导致小鼠精原干细胞自我更新和分化异常、减数分裂不能正常进入、小鼠精子发生受阻,雄性不育。为了深入探究Bud31调控的可变剪接分子网络及靶基因,研究人员利用精原细胞进行SAMRT-Seq和RIP-Seq,生物信息学分析发现Bud31主要影响外显子跳跃和内含子保留两种剪接模式;进一步分析发现,Bud31调控包括Cdk2基因在内众多基因的选择性剪接。利用迷你基因、RNA pull-down等方法,研究团队发现敲除Bud31引起Cdk2基因1号内含子保留的异构体增加,编码蛋白的经典异构体显著减少,并最终导致Cdk2蛋白水平的降低。
综上所述,本研究发现剪接因子Bud31及其调控的可变剪接分子网络在精原干细胞自我更新、分化中发挥重要作用。该研究丰富了RNA剪接调控的机制,并为男性不育的病因提供了理论依据。
上述研究得到国家自然科学基金项目、国家重点研发计划项目等基金的资助。同时特别感谢苏州大学邵常顺教授、山东大学高等医学研究院李石洋教授和香港中文大学路钢教授、中国科学院动物研究所高飞教授、中国科学院分子细胞科学卓越创新中心童明汉教授的大力支持。
文章链接:https://www.nature.com/articles/s41418-022-01057-1