近日,山东大学药学院姜新义、赵坤团队在Cell Reports Medicine上发表题为“Synthetic cleavage-resistant TREM2 boosts macrophage efferocytosis to treat inflammatory diseases”的研究论文,通过工程化改造TREM2受体,构建一种抗ADAM17剪切的合成TREM2受体(CRT),并结合“eat-me”磷脂酰丝氨酸(PS)功能化LNP(pLNP)实现巨噬细胞选择性递送mRNA,在小鼠代谢功能障碍相关的脂肪性肝炎(MASH)与动脉粥样硬化模型中有效降低凋亡细胞负担并促进炎症消退。山东大学药学院姜新义和赵坤等为论文共同通讯作者,药学院研究生董祥晖和赵晓天为共同第一作者。

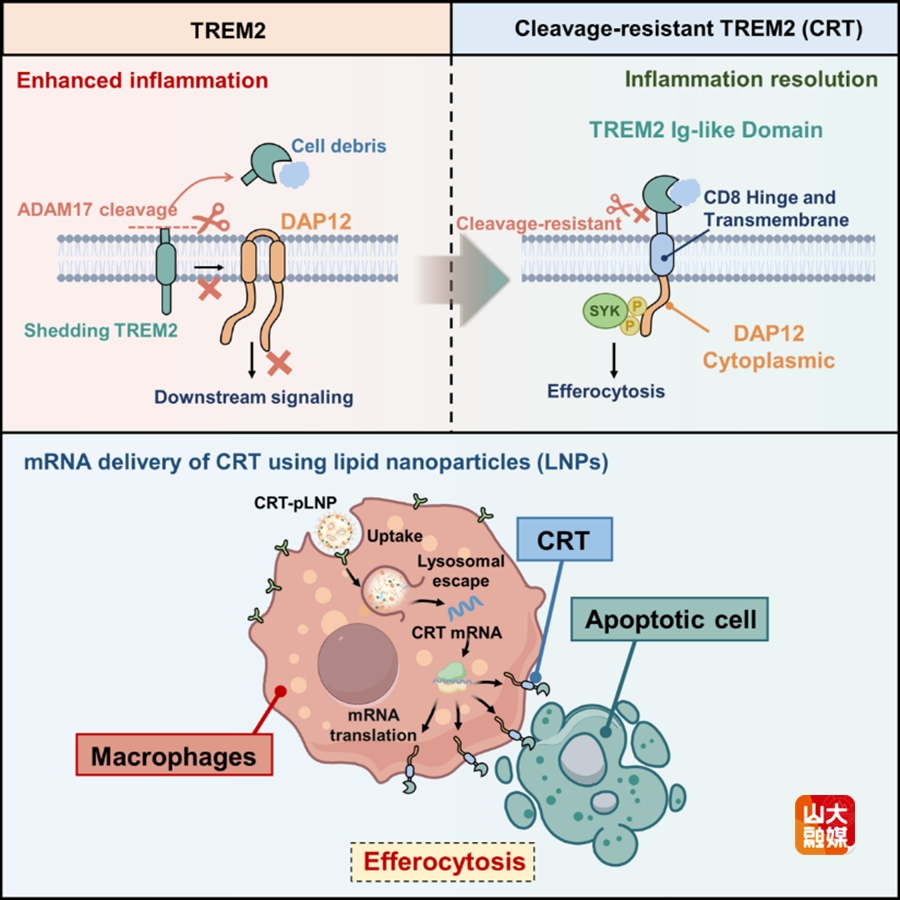
机理模式图
研究团队围绕“TREM2在炎症环境中易被ADAM17剪切失活”这一关键瓶颈,设计了多种CRT变体,并在报告系统中验证其表达、成熟与膜定位后进行功能筛选。与WT TREM2相比,CRT在凋亡细胞刺激下可更早达到峰值并产生更强的信号输出,其中Type IV表现最优,被确定为后续研究的核心构型;同时,相关实验通过检测全长TREM2与sTREM2,证明CRT具有更强的抗剪切特征。在巨噬细胞中表达CRT后,TREM2缺失导致的efferocytosis缺陷被显著恢复;并且在炎症刺激条件下,CRT-Ms呈现更低的促炎状态,提示CRT不仅增强清除凋亡细胞能力,也能在炎症背景下推动巨噬细胞向抗炎方向重编程。
为实现CRT mRNA在巨噬细胞中的高效递送,研究团队构建了一套基于氨基酸衍生离子化脂质的pLNP文库,并系统评估其在巨噬细胞中的转染效率。通过微流控快速制备EGFP-mRNA负载的pLNP组合,对不同脂质结构及配比进行体外筛选。流式细胞术结果显示,不同pLNP在RAW264.7细胞中的转染效率存在显著差异,其中以DKP-2-O为核心脂质的R17配方表现最优。随后在骨髓来源巨噬细胞中进一步验证,该配方同样表现出显著高于常规LNP的mRNA摄取与表达能力。
在两种经典MASH模型中,CRT治疗均体现出“增强清除凋亡细胞→降低炎症→改善纤维化/脂代谢结局”的连贯效应。在LDLr-KO动脉粥样硬化模型中,CRT治疗增强斑块内巨噬细胞与凋亡细胞的共定位/清除能力;在病理结局上,CRT组斑块坏死核心比例降低、纤维帽增厚,提示斑块稳定性提升。与此同时,TUNEL显示斑块内凋亡细胞数量明显下降,并且斑块局部与血浆中的TNF-α、IL-1β、IL-6等促炎因子同步降低,提示CRT可在斑块微环境中同时“清除死亡细胞+压低炎症驱动”。
该研究通过构建合成剪切抗性TREM2受体,并利用团队搭建的mRNA纳米递送平台在体内实现了巨噬细胞的原位功能重编程,有效恢复并放大炎症环境中受损的胞葬通路,从而在代谢相关脂肪性肝炎与动脉粥样硬化等模型中同步降低凋亡细胞负担并缓解炎症反应。该研究为以死亡细胞堆积为驱动因素的多种慢性炎症性疾病提供了新的干预思路。