近日,山东大学齐鲁医院放射科于德新教授与山东大学晶体材料研究院刘宏教授团队围绕磁性锰基纳米材料诱导铁死亡以增益乳腺癌和胰腺癌免疫治疗及其诊疗一体化研究方面取得系列研究成果,相关成果发表在生物材料领域高水平期刊Advanced Functional Materials、Chemical Engineering Journal和Biomaterials Research等期刊。
成果1:GSH-Responsive Mn2+Burst Nanoboxes as Mitophagy Intervention Agents Augment Ferroptosis and Chemoimmunotherapy in Triple-Negative Breast Cancer
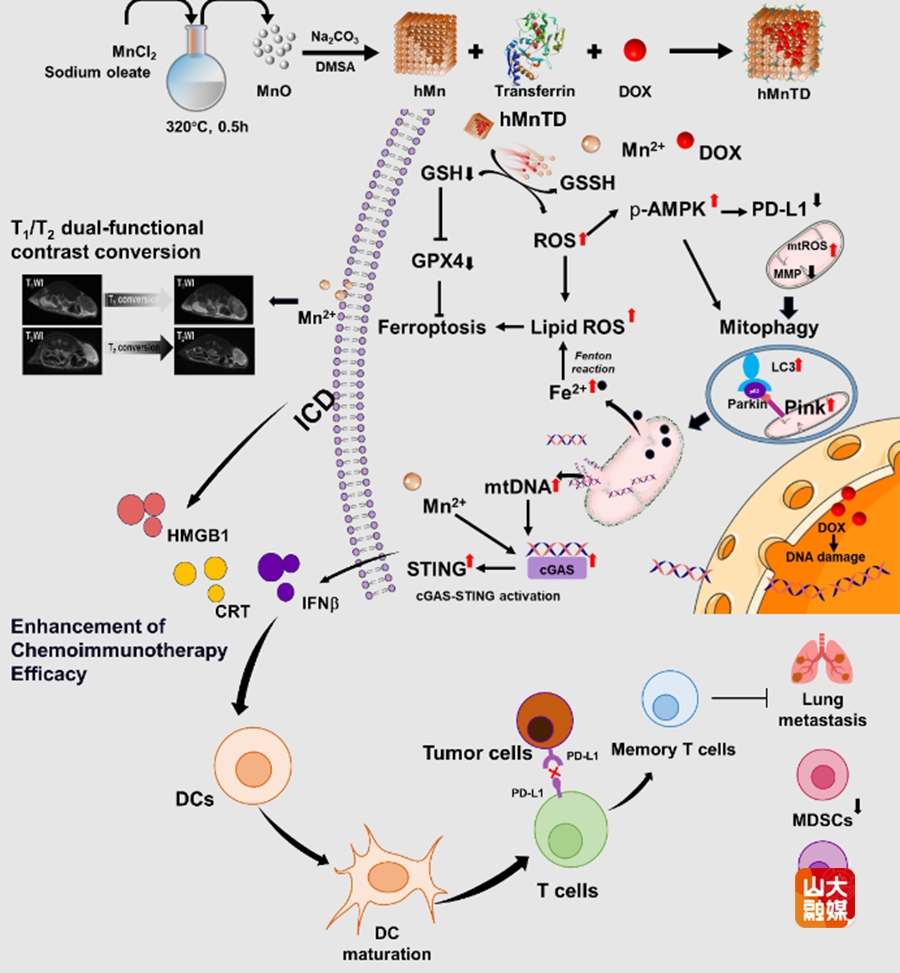
三阴性乳腺癌占乳腺癌总数的15%—20%,肿瘤组织高度异质性和耐药性,化疗效果不佳。研究表明,免疫检查点抑制剂与化疗联合应用可显著提升患者的无进展生存期。然而,三阴性乳腺癌高度抑制的免疫微环境阻碍了化学免疫治疗效果。研究团队围绕TNBC化学免疫治疗问题合成了具有三重功效的GSH响应性诊疗一体化空性氧化锰纳米盒(hMnTD)。该纳米盒能够通过消耗肿瘤细胞内的GSH水平及ROS的产生,激活肿瘤细胞中的线粒体自噬和铁死亡,增强化疗疗效。纳米盒通过AMPK和cGAS-STING通路的激活启动了强大的抗肿瘤免疫反应,增强了化学免疫治疗效果。并通过GSH响应性T1/T2双模态成像,实现了药物递送过程的可视化监测。研究设计的GSH响应性纳米盒克服了TNBC固有的免疫抑制微环境和化疗诱导的PD-L1治疗耐药性。该研究从肿瘤氧化还原平衡调节这一研究方向着手,阐明了TNBC化学免疫治疗中线粒体自噬相关铁死亡增敏的机制和治疗潜力。研究成果发表在AdvancedFunctionalMaterials(中科院一区,IF=18.5),于德新教授、刘宏教授、山东大学晶体材料研究院教授桑元华为论文的共同通讯作者,齐鲁医院放射科博士研究生张高瑞、山东大学晶体材料研究院段佳志博士为论文共同第一作者,山东大学为第一作者和通讯作者单位。
成果2:Lipid Acid Metabolism Reprogramming Nanoagent Induces Ferroptosis Storm and cGAS-STING Activation for Metal-immunotherapy of Triple Negative Breast Cancer
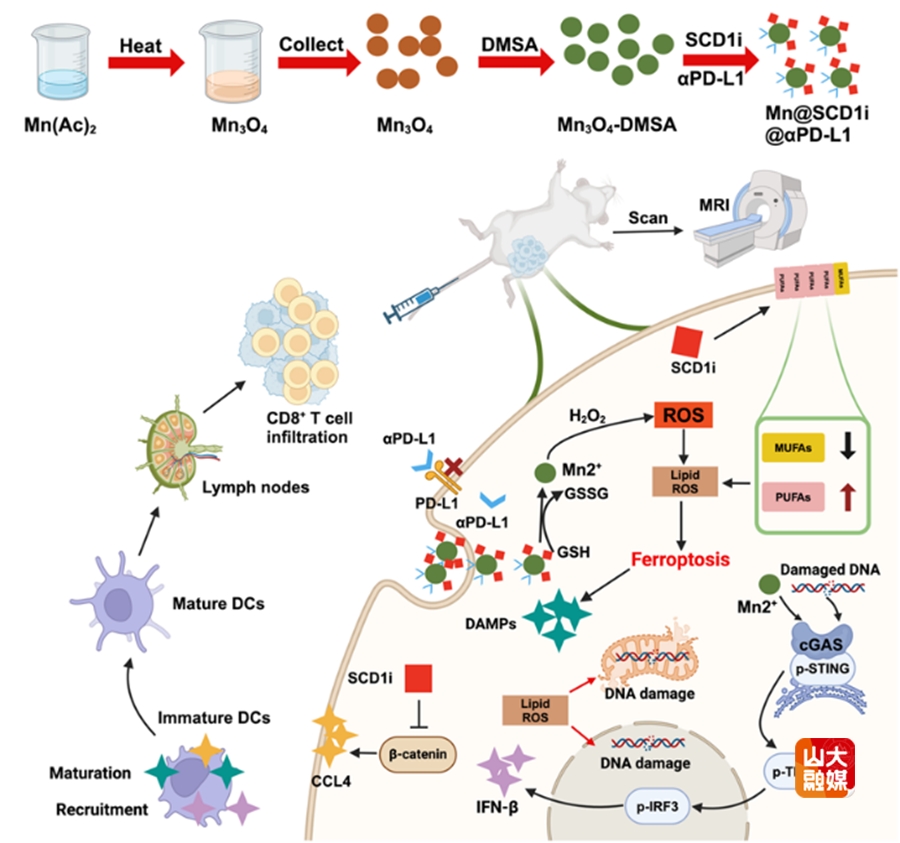
针对三阴性乳腺癌脂肪酸代谢异常导致的铁死亡抑制问题进一步构建了具有脂肪酸代谢调控能力的锰基纳米体系。该纳米体系利用脂肪酸代谢调控实现了铁死亡和cGAS-STING通路激活,从而通过改善抑制性肿瘤免疫微环境增效三阴性乳腺癌免疫治疗疗效。该纳米体系通过Mn3O4纳米载体连接SCD1i(一种抑制单不饱和脂肪酸合成的SCD1蛋白抑制剂)和αPD-L1,调节肿瘤细胞脂肪酸代谢平衡,增强脂质过氧化进而实现铁死亡诱导,激活cGAS-STING通路,用于金属免疫治疗和MR成像,最终达到三阴性乳腺癌免疫治疗增效和治疗过程实时MRI监控的双重目的。研究成果发表在Chemical Engineering Journal(中科院一区,IF=13.4),于德新教授、段佳志为论文的共同通讯作者,齐鲁医院放射科硕士研究生周大卫、博士研究生张高瑞为论文共同第一作者,山东大学为第一作者和通讯作者单位。
成果3:Cascading Catalytic Nanozyme Enhance Ferroptosis-Mediated Chemoimmunotherapy via the cGAS-STING and IL-6/STAT3 Pathways
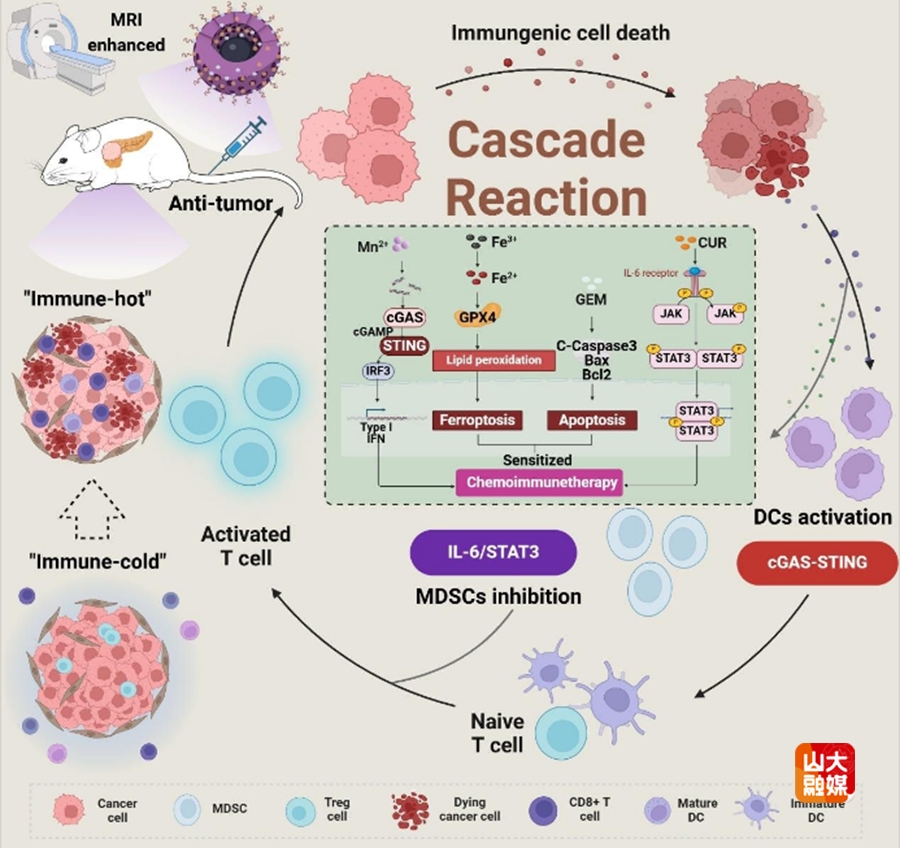
胰腺导管腺癌免疫抑制肿瘤微环境和化疗药物导致的抑制作用显著降低了化学免疫治疗的疗效。在肿瘤微环境中诱导铁死亡和抑制髓系衍生抑制细胞(MDSC)以增强树突状细胞抗原呈递可能为提高化学免疫治疗的疗效提供了一种有前景的策略。在这项研究中,研究团队设计了负载化疗药物吉西他滨和免疫佐剂姜黄素的Fe-Mn壳核结构纳米酶。这些纳米酶在谷胱甘肽(GSH)和H2O2的作用下引发肿瘤细胞的铁死亡,增强吉西他滨的治疗效果,并进一步诱导免疫原性细胞死亡和DNA损伤。Mn2+的响应性释放通过cGAS STING途径增强了树突状细胞的成熟和免疫反应。并进一步通过响应性触发释放的姜黄素通过IL-6/STAT3途径调节MDSC,增强免疫细胞的肿瘤杀伤能力。最后,Fe2+和Mn2+的GSH响应性释放实现了肿瘤T1/T2双模成像和体外治疗过程的监测。本研究广泛探索了FM作为GSH响应性MR成像和监测核壳纳米酶增强胰腺癌症化学免疫疗法的可行性。研究成果发表在Chemical Engineering Journal(中科院一区,IF=13.4),于德新教授、段佳志为论文的共同通讯作者,齐鲁医院放射科博士研究生赵雨萱、博士研究生张高瑞为论文共同第一作者,山东大学为第一作者和通讯作者单位。
此外,为进一步解决胰腺导管腺癌组织固体应力(TSS)对化疗药物的传递和渗透阻碍问题,研究团队在Biomaterials Research杂志(中科院二区,IF=8.1)发表了“Nanotension Relief Agent Enhances Tissue Penetration by Reducing Solid Stress in Pancreatic Ductal Adenocarcinoma via Rho/ROCK Pathway Inhibition”为题的研究成果。
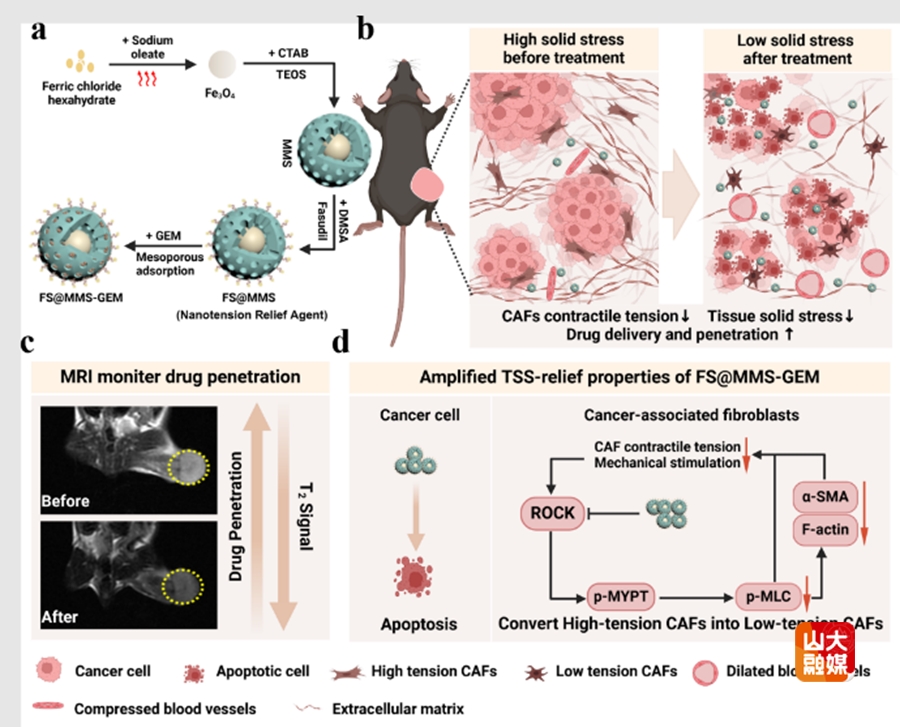
该研究设计了一种pH响应性载药张力缓解纳米载体(FS@MMS-GEM)。纳米载体通过抑制磷酸化肌凝蛋白轻链(p-MLC)调节Rho/Rho相关激酶(ROCK)通路,实现了TSS快速调节,从而通过增强荷载吉西他滨的渗透性,提高了化疗药物抗癌疗效。此纳米体系在体内外均具有稳定的铁浓度依赖性的MR成像能力,实现了对肿瘤组织渗透性的实时监测。这种基于改善CAFs张力提高渗透性的纳米策略为胰腺导管腺癌及相关富间质肿瘤的治疗提供了一种新的治疗思路。于德新教授、段佳志博士为论文的共同通讯作者,齐鲁医院放射科硕士研究生余斐然、博士研究生张高瑞为论文共同第一作者,山东大学为第一作者和通讯作者单位。
以上系列研究工作得到了国家自然科学基金、山东省自然科学基金等项目的资助,同时得到了齐鲁医院基础医学研究中心、山东大学纳米分子与功能成像转化医学研究中心、山东大学齐鲁影像医学研究所等平台的大力支持。