近日,山东大学药学院李敏勇教授团队与美国德州农工大学、北京师范大学的研究团队合作在Journal of the American Chemical Society(J. Am. Chem. Soc.April 24. 2020 doi:10.1021/jacs.0c02949)上发表了光控CRAC通道抑制剂的研究成果,该光控抑制剂成功用于治疗斑马鱼模型上的Stormorken综合症。
钙释放激活钙通道(CRAC通道)在所有的兴奋性和非兴奋性细胞中广泛存在,与一系列重要的生理功能密切相关。构成CRAC通道的STIM和ORAI蛋白介导钙池操纵钙内流(SOCE)产生钙信号。SOCE是由内质网(ER)内腔内Ca2+储存耗竭和STIM1 ER-管腔结构域多聚化引发。激活的STIM1分子积聚在ER-PM连接处,结合并激活细胞膜上的门控ORAI1通道,引发钙内流。异常的STIM-ORAI信号与多种人类疾病相关,包括免疫缺陷、自身免疫炎性疾病、心脏肥大、癌症转移和Stormorken综合症。研究表明,Stormorken综合症是由ORAI1或STIM1(例如R304W)中的获得性突变引起的,导致部分Ca2+进入细胞。因此CRAC通道作为一种很有前途的治疗靶点受到了广泛关注。
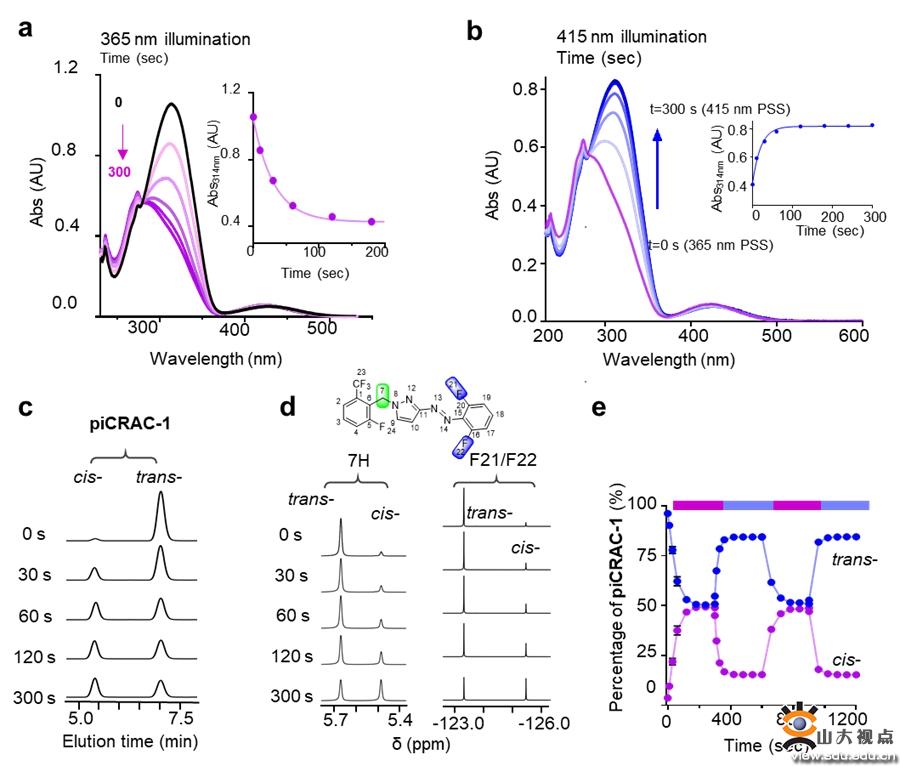
光药理学方法利用可光切换的分子在时空上精确控制生物活性靶点,如离子通道、受体、酶和核酸。为了更精确地控制CRAC通道的活性,李敏勇教授团队开发了一系列光控CRAC通道抑制剂,以良好的时空分辨率控制Ca2+信号,从而对与CRAC通道过度激活相关的疾病进行光药理调节。该团队基于N-芳基苯甲酰胺类CRAC通道抑制剂(GSK系列化合物和Synta 66)开发了一系列可光切换的CRAC通道调节剂。在这些化合物中引入偶氮基得到piCRACs,实现反式和顺式构型之间的快速和可逆光转化,从而使piCRACs对CRAC通道显示出相反的抑制作用。经过一系列的实验发现piCRAC-1光热稳定好、良好的光化学性质、高时空精度、能够高选择地光诱导CRAC通道开关。
首先该团队通过UV-Vis、HPLC和NMR方法探讨piCRAC-1的光化学性质,对紫外吸收光谱、紫外以及蓝光照射下的trans-cis转换率、光热稳定性以及光敏特性进行测定,通过对CRAC通道和下游Ca2+响应转录因子(NAFT核内转运)的光依赖抑制作用考察piCRAC-1的生物活性。研究发现trans-piCRAC-1在50 µM以下对SOCE几乎没有抑制,然而cis-piCRAC-1对SOCE有明显的抑制作用(IC50=0.5 µM)。同时,cis-piCRAC-1对CRAC通道电流抑制高达80%,而trans没有抑制。同样紫外光照下TG诱导的NFAT核内转运被piCRAC-1显著抑制。piCRAC-1作为无创光学工具可以用于治疗CRAC通道相关的Stormorken综合征。在斑马鱼出血实验中,piCRAC-1在紫外光下能够拯救血小板减少症(78.9%),抑制出血,蓝光、无光下仅有轻微的拯救效果。
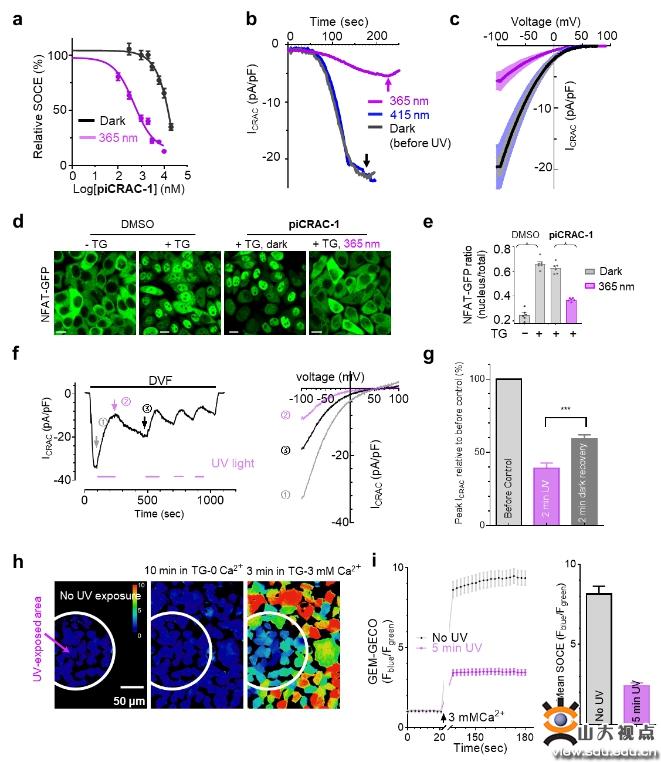
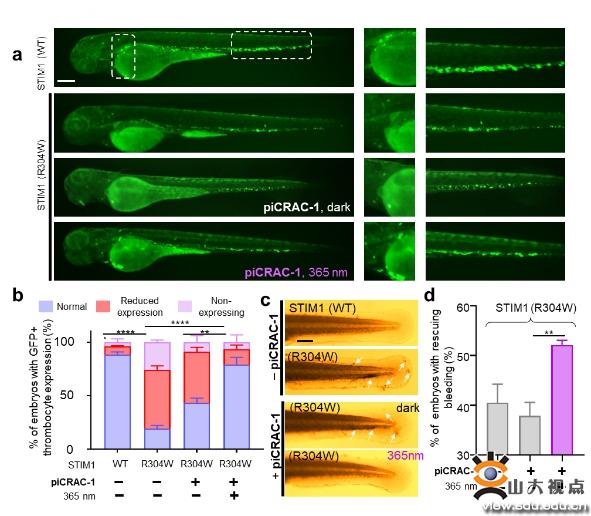
该研究成果显示piCRAC-1以高时空精度对细胞内CRAC通道和依赖Ca2+信号的生理过程进行光诱导调节。PiCRAC-1可以作为潜在治疗剂用于光控调节与钙信号失调相关的病理过程,例如由CRAC通道过度激活引起的Stormorken综合征。该研究成果有助于Ca2+通道的结构-功能关系的研究,而且在研究无数Ca2+调节信号过程和与Ca2+动态平衡相关的人类疾病方面具有潜在应用价值。
李敏勇教授团队博士研究生杨兴业、周育斌教授团队博士研究生马国林、王友军教授团队博士研究生郑思思为该论文的共同第一作者。该工作得到了国家自然科学基金、山东大学杰出中青年学者、山东省泰山学者、山东省自然科学基金等项目的资助。
文章链接:https://doi.org/10.1021/jacs.0c02949